BAB
1
PENDAHULUAN
1.1 Latar belakang
Secara umum untuk
mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur
suhu benda tersebut. Jika suhunya tinggi, maka kalor yang dikandung oleh benda
sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang
dikandung sedikit.
Kalorimeter adalah alat
yang digunakan untuk mengukur kalor atau energi panas. Pertukaran energi kalor
merupakan dasar teknik yang dikenal dengan nama kalorimetri, yang merupakan
pengukuran kuantitatif dari pertukaran kalor.
Kalorimetri adalah
pengukuran kalor yang menggunakan alat kalorimeter. Kalorimeter ada dua jenis
yaitu kalorimeter bom dan kalorimeter sederhana. Yang mendasari percobaan
kalorimeter ini adalah teori asas Black.
Oleh karena itu
dilakukan percobaan tentang tetapan kalorimetri agar dapat mempelajari tentang
kalor atau pengukuran energi panas serta mengetahui sifat-sifat dari
kalorimeter.
1.2 Tujuan
-
Mengetahui fungsi dari kalorimeter
-
Mengetahui hubungan asas Black terhadap
percobaan
-
Mengetahui nilai Cp dari kalorimeter
BAB
2
TINJAUAN
PUSTAKA
Energi
mekanik akibat gerakan partikel materi dan dapat dipindah dari satu tempat ke
tempat lain disebut kalor.
Pengukuran
jumlah kalor reaksi yang diserap atau dilepaskan pada suatu reaksi kimia dengan
eksperimen disebut kalorimetri. Dengan menggunakan hukum Hess, kalor reaksi
suatu reaksi kimia dapat ditentukan berdasarkan data perubahan entalpi
pembentukan standar, energi ikatan dan secara eksperimen. Proses dalam
kalorimetri berlangsung secara adiabatik, yaitu tidak ada energi yang lepas
atau masuk dari luar ke dalam kalorimeter.
Kalor
yag dibutuhkan untuk menaikan suhu kalorimeter sebesar 10oC pada air
dengan massa 1 gram disebut tetapan kalorimetri.
Dalam proses ini berlaku azas Black, yaitu:
Qlepas=Qterima
Qair panas= Qair dingin+
Qkalorimetri
m1
c (Tp-Tc)= m2 c (Tc-Td)+ C (Tc-Td)
Keterangan:
m1=
massa air panas
m2=
massa air dingin
c = kalor jenis air
C = kapasitas kalorimeter
Tp
= suhu air panas
Tc
= suhu air campuran
Td
= suhu air dingin
Sedang
hubungan kuantitatif antara kalor dan bentuk lain energi disebut termodinamika.
Termodinamika dapat didefinisikan sebagai cabang kimia yang menangani hubungan
kalor, kerja, dan bentuk lain energi dengan kesetimbangan dalam reaksi kimia
dan dalam perubahan keadaan.
Hukum
pertama termodinamika menghubungkan perubahan energi dalam suatu proses
termodinamika dengan jumlah kerja yang dilakukan pada sistem dan jumlah kalor
yang dipindahkan ke sistem (Keenan, 1980).
Hukum
kedua termodinamika yaitu membahas tentang reaksi spontan dan tidak spontan.
Proses spontan yaitu reaksi yang berlangsung tanpa pengaruh luar. Sedangkan
reaksi tidak spontan tidak terjadi tanpa bantuan luar.
Hukum
ketiga termodinamika menyatakan bahwa entropi dari Kristal sempurna murni pada
suhu nol mutlak ialah nol. Kristal sempurna murni pada suhu nol mutlak
menunjukan keteraturan tertinggi yang dimungkinkan dalam sistem termodinamika.
Jika suhu ditingkatkan sedikit di atas 0 K, entropi meningkat. Entropi mutlak
selalu mempunyai nilai positif.
Kalor
reaksi dapat diperoleh dari hubungan maka zat (m), kalor jenis zat (c) dan
perubahan suhu (ΔT), yang dinyatakan dengan persamaan berikut
q = m.c.ΔT
Keterangan:
q= jumlah kalor (Joule)
m=
massa zat (gram)
ΔT=
perubahan suhu (takhir-tawal)
C= kalor jenis
Kalorimeter
adalah jenis zat dalam pengukuran panas dari reaksi kimia atau perubahan fisik.
Kalorimetri termasuk penggunaan kalorimeter. Kata kalormetri berasal dari
bahasa latin yaitu calor, yang berarti panas. Kalorimetri tidak langsung
(indirect calorimetry) menghitung panas pada makhluk hidup yang memproduksi
karbon dioksida dan buangan nitrogen (ammonia, untuk organisme perairan, urea,
untuk organisme darat) atau konsumsi oksigen. Lavoisier (1780) menyatakan bahwa
produksi panas dapat diperkirakan dari konsumsi oksigen dengan menggunakan
regresi acak. Hal ini membenarkan teori energi dinamik. Pengeluaran panas oleh
makhluk hidup ditempatkan di dalam kalorimeter untuk dilakukan langsung, di
mana makhluk hidup ditempatkan di dalam kalorimeter untuk dilakukan pengukuran.
Jika benda atau sistem diisolasi dari alam, maka temperatur harus tetap
konstan. Jika energi masuk atau keluar, temperatur akan berubah. Energi akan
berpindah dari satu tempat ke tempat yang disebut dengan panas dan kalorimetri
mengukur perubahan suatu tersebut. Bersamaan dengan kapasitas dengan kapasitas panasnya, untuk menghitung perpindahan panas.
Kalor
adalah berbentuk energi yang menyebabkan suatu zat memiliki suhu. Jika zat
menerima kalor, maka zat itu akan mengalami suhu hingga tingkat tertentu
sehingga zat tersebut akan mengalami perubahan wujud, seperti perubahan wujud
dari padat menjadi cair. Sebaliknya jika suatu zat mengalami perubahan wujud
dari cair menjadi padat maka zat tersebut akan melepaskan sejumlah kalor. Dalam
Sistem Internasional (SI) satuan untuk kalor dinyatakan dalam satuan kalori
(kal), kilokalori (kkal), atau joule (J) dan kilojoule (kj).
1
kilokalori= 1000 kalori
1
kilojoule= 1000 joule
1
kalori = 4,18 joule
1 kalori adalah banyaknya kalor yang diperlukan
untuk memanaskan 1 gram air sehingga suhunya naik sebesar 1oC atau
1K. jumlah kalor yang diperlukan untuk menaikkan suhu 1oC atau 1K
dari 1 gram zat disebut kalor jenis Q=m.c. ΔT, satuan untuk kalor jenis adalah
joule pergram perderajat Celcius (Jg-1oC-1) atau joule
pergram per Kelvin (Jg-1oK-1) (Petrucci, 1987).
Pengukuran
kalorimetri suatu reaksi dilakukan dengan menggunakan alat yang disebut
kalorimeter. Ada beberapa jenis kalorimeter seperti: kalorimeter termos,
kalorimeter bom, kalorimeter thienman, dan lain-lain. Kalorimeter yang lebih
sederhana dapat dibuat dari sebuah bejana plastik yang ditutup rapat sehingga
bejana ini merupakan sistim yang terisolasi.
Cara kerjanya adalah sebagai berikut:
Sebelum zat-zat pereaksi direaksikan di dalam
kalorimeter, terlebih dahulu suhunya diukur, dan usahakan agar masing-masing
pereaksi ini memiliki suhu yang sama. Setelah suhunya diukur kedua larutan tersebut
dimasukkan ke dalam kalorimeter sambil diaduk agar zat-zat bereaksi dengan
baik, kemudian suhu akhir diukur.
Jika reaksi dalam kalorimeter berlangsung secara
eksoterm maka kalor yang timbul akan dibebaskan ke dalam larutan itu sehingga
suhu larutan akan naik, dan jika reaksi dalam kalorimeter berlangsung secara
endoterm maka reaksi itu akan menyerap kalor dari larutan itu sendiri, sehingga
suhu larutan akan turun. Besarnya kalor yang diserap atau dibebaskan reaksi itu
adalah sebanding dengan perubahan suhu dan massa larutan jadi,
Qreaksi=
mlarutan. Clarutan. ΔT
Kalorimetri
yang lebih teliti adalah yang lebih terisolasi serta memperhitungkan kalor yang
diserap oleh perangkat kalorimeter (wadah, pengaduk, termometer). Jumlah kalor
yang diserap/dibebaskan kalorimeter dapat ditentukan jika kapasiatas kalor dari
kalorimeter diketahui. Dalam hal ini jumlah kalor yang dibebaskan /diserap oleh
reaksi sama dengan jumlah kalor yang diserap/dibebaskan oleh kalorimeter
ditambah dengan jumlah kalor yang diserap/dibebaskan oleh larutan di dalam
kalorimeter. Oleh karena energi tidak dapat dimusnahkan atau diciptakan, maka
Qreaksi=
(-Qkalorimeter- Qlarutan)
Kalorimeter sederhana
Pengukuran
kalor reaksi, setara kalor reaksi pembakaran dapat dilakukan dengan menggunakan
kalorimeter pada tekanan tetap yaitu dengan kalorimeter sederhana yang dibuat
dan gelas stirofoam. Kalorimeter ini biasanya dipakai untuk mengukur kalor
reaksi yang reaksinya berlangsung dalam fase larutan (misalnya reaksi
netralisasi asam-basa/netralisasi, pelarutan dan pengendapan) (Syukri, 1999).
BAB
3
METODOLOGI
PERCOBAAN
3.1
Alat dan bahan
3.1.1 Alat-alat
-
Termometer 0-50oC
-
Gelas ukur 50 ml
-
Stopwatch
-
Pipet gondok
-
Pembakar gas atau sumber panas listrik
-
Gelas piala
-
Kalorimeter
3.1.2 Bahan-bahan
-
Air (H2O)
-
Sabun cair
-
Bahan isolasi
-
Tissue
3.2
Prosedur percobaan
-
Dipersiapkan alat dan bahan yang alan
digunakan pada percobaan kali ini
-
Dipasang alat seperti termometer dan
pengaduk pada kalorimeter
-
Diukur 50 ml air dengan menggunakan gelas
ukur
-
Dimasukkan air ke dalam kalorimeter
-
Diaduk dan dicatat suhu air dalam kalorimeter
setiap 30 detik hingga menit ke-4
-
Dimasukkan air panas tepat pada menit
ke-4 sebanyak 50 ml dengan suhu yang telah diketahui yaitu minimum 35oC
dan maksimal 45oC
-
Dicatat suhu air dalam kalorimeter tiap
30 detik sampai menit ke delapan sambil terus diaduk
BAB
4
HASIL
DAN PEMBAHASAN
4.1
Hasil pengamatan
Waktu,
menit
|
Suhu,
oC
|
Waktu,
menit
|
Suhu,
oC
|
0
|
28
|
4,5
|
36
|
0,5
|
29
|
5,0
|
36
|
1,0
|
29
|
5,5
|
36
|
1,5
|
29
|
6,0
|
36
|
2,0
|
29
|
6,5
|
35
|
2,5
|
29
|
7,0
|
35
|
3,0
|
29
|
7,5
|
35
|
3,5
|
29
|
8,0
|
35
|
4,0
|
Penambahan
air panas
|
4.2
Perhitungan
4.3
Pembahasan
Pertukaran
energi kalor merupakan dasar teknik yang dikenal dengan nama kalorimetri, yang
merupakan pengukuran kuantitatif dari pertukaran kalor. Kalorimetri adalah
pengukuran kalor yang menggunakan alat kalorimeter. Kalorimetri adalah
pengukuran kuantitas perubahan panas. Sebagai contoh, jika energi dari reaksi
kimia eksotermal diserap air, perubahan suhu dalam air akan mengukur jumlah
panas yang ditambahkan.
Prinsip dari
kalorimeter adalah memanfaatkan perubahan fase dari sifat fisik suatu zat untuk
membandingkan kapasitas penerimaan kalor dari zat-zat yang berbeda.
Prinsip
pengukuran pada percobaan ini disebut kalorimetri. Alat pengukur kalor jenis
zat berdasarkan prinsip kalorimetri disebut kalorimeter. Pengukuran kalor jenis
dengan kalorimeter didasarkan pada asas Black.
Teori yang
dikemukakan oleh Joseph Black atau lebih dikenal dengan azas Balck. Yaitu,
apabila dua benda yang suhunya berbeda dan dicampur, maka benda yang lebih
panas melepas kalor kepada benda yang lebih dingin sampai suhu keduanya sama.
Banyaknya kalor yang dilepas benda yang lebih panas sama dengan banyaknya kalor
yang diterima benda yang lebih dingin. Sebuah benda untuk menurunkan ΔT akan
melepaskan kalor yang sama besarnya dengan banyaknya kalor yang dibutuhkan
benda itu untuk menaikkan suhunya sebesar
ΔT juga. Teorinya adalah Qlepas=Qterima,
m1 c1 (T1-Ta)= m2 c2 (Ta-T2)
Ada
beberapa jenis kalorimeter. Pertama adalah kalorimeter bom. Merupakan
kalorimeter yang khusus digunakan untuk menentukan kalor dari reaksi-reaksi
pembakaran. Kalorimeter ini terdiri dari sebuah bom (tempat berlangsungnya
reaksi pembakaran, terbuat dari bahan stainless steel dan diisi dengan gas
oksigen pada tekanan tinggi) dan sejumlah air yang dibatasi dengan wadah yang
kedap panas. Reaksi pembakaran yang terjadi di dalam bom, akan menghasilkan
kalor dan diserap oleh air dan bom. Oleh karena tidak ada kalor yang terbuang
ke lingkungan, maka: Qreaksi=
(-Qair+ Qbom)
Jumlah kalor yang diserap oleh air dapat dihitung
dengan rumus Qair= m.Cp.ΔT. jumlah kalor yang
diserap oelh bom dapat dihitung dengan rumus Qbom= Cbom.ΔT.
reaksi yang berlangsung pada kalorimeter bom berlangsung pada volume tetap
(ΔV=nol). Oleh karena itu, perubahan kalor yang terjadi di dalam sistem=
perubahan energi dalamnya. Fungsi dari kalorimeter bom adalah untuk menentukan
kalor dari reaksi-reaksi pembakaran.
Jenis
kedua adalah kalorimeter sederhana. Pengukuran kalor reaksi, selain kalor
reaksi pembakaran dapat dilakukan dengan menggunakan kalorimeter sederhana yang
dibuat dari gelas stirofoam. Kalorimeter ini biasanya dipakai untuk mengukur
kalor reaksi yang reaksinya berlangsung dalam fase larutan (misalnya reaksi
netralisasi asam-basa/netralisasi, pelarutan dan pengendapan). Pada kalorimeter
ini, kalor reaksi = jumlah kalor yang diserap/dilepaskan larutan sedangkan
kalor yang diserap oleh gelas dan lingkungan diabaikan. Qreaksi= -(
Qlarutan+ Qkalorimeter). Qkalorimeter.Ckalorimeter.ΔT.
dengan: Ckalorimeter= kapasitas kalor kalorimeter (J/oC)
atau (J/K). jika harga kapasitas kalor kalorimeter sangat kecil, maka dapat
diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan
suhu larutan dalam kalorimeter. Pada kalorimeter ini, reaksi berlangsung pada
tekana tetap (Δp=nol) sehingga perubahan
kalor yang terjadi dalam sistem=perubahan entalpinya. Fungsi dari kalorimeter
sederhana adalah dalam pengukuran kalor reaksi.
Pada
percobaan tetapan kalorimeter dengan Tap=44oC. setelah dihitung
didapatkan Tad=28,875oC dan Tt=35,5oC. massa air yang
dihitung didapatkan hasil 50 gram. Jumlah kalor yang diserap air dingin
didapatkan hasil 1383,63 J. Jumlah kalor yang dilepas air panas 1776,5 J.
Jumlah kalor yang diserap kalorimeter 391,87 J. Dan tetapan kalorimeter
didapatkan hasil 59,2 J/oC. Pada tabel pengamatan hasil percobaan
dapat dilihat bahwa suhu dari menit ke menit yang dicatat setiap 30 detik itu
tidak berubah suhunya, ini membuktikan sifat kalorimeter yaitu menjaga suhu,
dan tidak ada pengaruh dari lingkungan.
Sifat-sifat
kalorimeter adalah menjaga suhu suatu zat dan tidak terpengaruh oleh
lingkungan, sifatnya dalam proses adalah secara adiabatic yaitu tidak ada energi
yang lepas atau masuk dari luar ke dalam kalorimeter. Berdasarkan azas Black
yaitu kalor yang diterima oleh kalorimeter sama dengan kalor yang diberikan
oleh zat yang dicari kalor jenisnya.
Terdapat
beberapa fungsi perlakuan yaitu pengadukan secara terus-menerus, bukan untuk
menaikkan suhu zat dalam kalorimeter, melainkan agar penyebaran kalor dapat
merata pada kalorimeter. Pemanasan H2O berfungsi untuk membandingkan
suhu air panas dan suhu air dingin di dalam kalorimeter. Pencampuran dan
pengukuran berfungsi untuk membuktikan fungsi kalorimeter yaitu dapat
menjaga/mempertahankan kalor.
Energi
yang diterima air dingin tidak sam dengan yang dilepas oleh air panas. Ini
dikarenakan sifat dari kalorimeter yang dapat menyerap kalor sehingga tidak
semuanya kalor dapat diterima oleh air dingin.
Menghitung
kapasitas panas kalorimeter yaitu dengan menggunakan azas Black, yaitu Qlepas=Qterima,
Qair panas=Qair dingin+ Qkalorimeter
m1.C.(Tp-Tc)= m2.C.(Tc-Td)+C.(Tc-Td)
Dengan menggunakan rumus ini maka akan dapat
dihitung kapasitas panasnya.
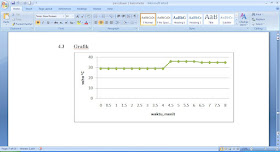
Dapat
dilihat dari grafik tetapan kalorimeter yaitu pada suhu 29oC yaitu
pada waktu 0,5 sampai 3,5. Kemudian pada suhu 36oC pada waktu 4,5
sampai 6,0 menurun menjadi 35oC pada waktu 6,5 sampai 8,0.
4.3
Grafik
BAB
5
PENUTUP
5.1
Kesimpulan
-
Kalorimeter berfungsi dalam pengukuran
panas secara kuantitatif yang masuk selama proses kimia.
-
Dalam kalorimeter hubungan asas Black
terhadap kalorimeter yaitu kalor pada sistem arah konstan apabila sistem
terisolasi sehingga Q masuk sama dengan Q keluar.
-
Dalam percobaan didapat nilai kapasitas
panas kalorimeter adalah 55,73 J/oC
5.2
Saran
Sebaiknya
di dalam percobaan ini menggunakan suhu yang berbeda-beda agar praktikan lebih
memahami tetntang sifat dari kalorimeter.
DAFTAR
PUSTAKA
Keenan. 1980. Kimia
untuk Universitas Jilid 1. Jakarta: Erlangga.
Petrucci,
Ralph H. 1987. Kimia Dasar Prinsip dan
Terapan Modern Jilid 2 Edisi 4. Jakarta: Erlangga.
Syukri,
S. 1999. Kimia Dasar 1. Bandung: ITB.


haduh panjang bgt!!! tp gk papa buat belajar
ReplyDeleteIzin copy ya, terima kasih:))))
ReplyDeletethank
ReplyDeleteHi mba!waah aku jga dari unmul loh hehe
ReplyDelete